Cardiovascular Pathophysiology and Extracellular Matrix
病態におけるPGE2の役割
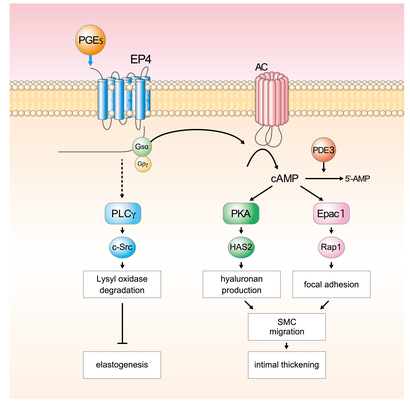
PGE2は代表的な脂質メディエーターであり、心血管系の様々な病態に伴い産生が亢進し、その病態における作用が注目されている。大動脈瘤ではPGE2の産生が亢進していることが知られており。これらの疾患の進行、増悪に寄与している可能性が高い。大動脈瘤で産生が亢進していることが知られているCOX-2を欠損させたマウスや、COX-2阻害薬を用いた検討によりCOX-2の抑制が大動脈瘤を抑制すると報告されている。このことからも、PGE2が大動脈瘤の病態の進行に大きく関与していることが裏付けられている。
大動脈瘤は無症状のうちに経過し突然破裂に至るが、破裂後の救命は極めて困難であり、臨床上の大きな問題点となっている。大動脈瘤は加齢とともに罹患率が上昇し、エコーによるスクリーニングでは、60歳以上の男性では人口の4-5%が3 cm以上の大動脈瘤を有していると報告されている。現在は、人工血管置換術または自己拡張性スプリング(ステント)に人工血管(グラフト)を縫着したステントグラフトの留置といった外科的治療が主流であり、疾患の進行を抑制する薬物治療は存在しない。

大動脈瘤におけるEP4シグナルの作用
大動脈瘤は、血管弾性線維を主体とする細胞外基質が減少するために血管壁が脆くなり、血圧負荷のため血管が拡大してゆくことで増悪する。マクロファージを主体とする炎症細胞が血管壁に浸潤して炎症を持続させる。特にインターロイキン6 (interleukin-6: IL-6)やIL-1b等が炎症性メディエーターとして働くことが知られている。また、平滑筋細胞やマクロファージなどからマトリクスメタロプロテアーゼ(matrix metalloproteinase: MMP)が産生され、なかでもMMP-2、MMP-9の活性が増加することで弾性線維の断裂や減少が起こる。
PGE2が大動脈瘤の進行に関与している可能性が報告されていたことから、筆者らはヒト大動脈瘤組織でPGE2受容体の発現を検討した。健常者の大動脈に比べて、大動脈瘤部位の平滑筋細胞にはEP4が多く発現することを見出した。また、血管弾性線維の破壊がみられる部位でEP4は高い発現を示した。大動脈瘤組織中のマクロファージがEP4を多く発現し、サイトカインを産生することは知られていたが、血管組織の大半を占める平滑筋細胞でも大動脈瘤でEP4が過剰に発現することが明らかとなった。
さらにヒト大動脈瘤からの初代平滑筋培養細胞を用いてEP4を刺激すると、MMP-2活性とIL-6産生の増加が見られた。2種類のマウス大動脈瘤モデルを用いてEP4の役割をさらに検討したところ、EP4ヘテロ欠損マウスでは塩化カルシウムによる大動脈瘤形成が73%抑制され、EP4とApoEのダブル欠損マウスで、アンジオテンシンIIによる大動脈瘤の形成が76%抑制された。
筆者らは大動脈瘤が部位特異的に発症することから、免疫細胞の関与だけではなく、血管自体を構成する平滑筋細胞の役割が重要であると考えた。そこで平滑筋特異的EP4過大発現マウスを作製して検討したところ、EP4を介して平滑筋細胞からIL-6が過剰に産生されることで、炎症性単球・マクロファージの血管への浸潤と活性化を促進し、大動脈瘤の増悪に関与していることが示された。
EP受容体を標的とした大動脈瘤治療の可能性
次にEP4拮抗薬が大動脈瘤の進行を抑制できるかを検討したところ、ApoE欠損マウスにアンジオテンシンIIを投与して作成した大動脈瘤は、EP4拮抗薬の経口投与により、45-87%の有意な抑制が認められ、この大動脈組織では、EP4拮抗薬により弾性線維の分解とMMP-2活性が有意に抑制されていた。さらにEP4拮抗薬の大動脈瘤に対する同様の抑制効果は、その後他のグループによっても示された。
さらにヒト大動脈瘤組織の器官培養でも、EP4拮抗薬はMMP-2活性とIL-6産生を有意に抑制した。マクロファージに発現するEP4はMCP-1の産生を抑制するため、EP4拮抗薬はMCP-1を増加させ大動脈瘤を増悪させる可能性も示されているが、筆者らのヒト大動脈瘤組織の器官培養の実験では、EP4拮抗薬はMCP-1の産生は増加させなかった。
これらの結果より、PGE2は病態で過剰に発現する平滑筋細胞におけるEP4受容体を介して、免疫細胞の活性化を引き起こすことで大動脈瘤の病態に関与することが明らかとなり、過剰なEP4シグナルを抑制することが大動脈瘤の治療につながる可能性が示された。
代表論文
- Hiromi T, Yokoyama U*, Kurotaki D, Mamun A, Ishiwata R, Ichikawa Y, Nishihara H, Umemura M, Fujita T, Yasuda S, Minami T, Goda M, Uchida K, Suzuki S, Takeuchi I, Masuda M, Breyer RM, Tamura T, and Ishikawa Y. Excessive EP4 signaling in smooth muscle cells induces abdominal aortic aneurysm by amplifying inflammation. Arterioscler Thromb Vasc Biol, 2020. 40: 1559-1573. DOI:10.1161/ATVBAHA.120.314297.
- Kato Y, Yokoyama U*, Fujita T, Umemura M, Kubota T, and Ishikawa Y. Epac1 deficiency inhibits basic fibroblast growth factor-mediated vascular smooth muscle cell migration. J Physiol Sci, 2019. 69: 175-184. DOI:10.1007/s12576-018-0631-7.
- Mamun A, Yokoyama U*, Saito J, Ito S, Hiromi T, Umemura M, Fujita T, Yasuda S, Minami T, Goda M, Uchida K, Suzuki S, Masuda M, and Ishikawa Y. A selective antagonist of prostaglandin E receptor subtype 4 attenuates abdominal aortic aneurysm. Physiol Rep, 2018. 6: e13878. DOI:10.14814/phy2.13878.
- Jin H, Fujita T, Jin M, Kurotani R, Namekata I, Hamaguchi S, Hidaka Y, Cai W, Suita K, Ohnuki Y, Mototani Y, Shiozawa K, Prajapati R, Liang C, Umemura M, Yokoyama U, Sato M, Tanaka H, Okumura S, and Ishikawa Y. Cardiac overexpression of Epac1 in transgenic mice rescues lipopolysaccharide-induced cardiac dysfunction and inhibits Jak-STAT pathway. J Mol Cell Cardiol, 2017. 108: 170-180. DOI:10.1016/j.yjmcc.2017.05.014.
- Akagi S, Nakamura K, Yokoyama U, Kasahara S, Sarashina T, Ejiri K, and Ito H. Enhanced EP4 Expression in a Pulmonary Artery Aneurysm With Dissection in a Patient With Pulmonary Arterial Hypertension. Circ Cardiovasc Imaging, 2017. 10. DOI:10.1161/CIRCIMAGING.116.005839.
- Kato Y, Yokoyama U*, Yanai C, Ishige R, Kurotaki D, Umemura M, Fujita T, Kubota T, Okumura S, Sata M, Tamura T, and Ishikawa Y. Epac1 Deficiency Attenuated Vascular Smooth Muscle Cell Migration and Neointimal Formation. Arterioscler Thromb Vasc Biol, 2015. 35: 2617-2625. DOI:10.1161/ATVBAHA.115.306534.
- Okumura S, Fujita T, Cai W, Jin M, Namekata I, Mototani Y, Jin H, Ohnuki Y, Tsuneoka Y, Kurotani R, Suita K, Kawakami Y, Hamaguchi S, Abe T, Kiyonari H, Tsunematsu T, Bai Y, Suzuki S, Hidaka Y, Umemura M, Ichikawa Y, Yokoyama U, Sato M, Ishikawa F, Izumi-Nakaseko H, Adachi-Akahane S, Tanaka H, and Ishikawa Y. Epac1-dependent phospholamban phosphorylation mediates the cardiac response to stresses. J Clin Invest, 2014. 124: 2785-2801. DOI:10.1172/JCI64784.
- Yokoyama U, Iwatsubo K, Umemura M, Fujita T, and Ishikawa Y. The prostanoid EP4 receptor and its signaling pathway. Pharmacol Rev, 2013. 65: 1010-1052. DOI:10.1124/pr.112.007195.
- Yokoyama U*, Ishiwata R, Jin MH, Kato Y, Suzuki O, Jin H, Ichikawa Y, Kumagaya S, Katayama Y, Fujita T, Okumura S, Sato M, Sugimoto Y, Aoki H, Suzuki S, Masuda M, Minamisawa S, and Ishikawa Y. Inhibition of EP4 signaling attenuates aortic aneurysm formation. PLoS One, 2012. 7: e36724. DOI:10.1371/journal.pone.0036724.
- Insel PA, Murray F, Yokoyama U, Romano S, Yun H, Brown L, Snead A, Lu D, and Aroonsakool N. cAMP and Epac in the regulation of tissue fibrosis. Br J Pharmacol, 2012. 166: 447-456. DOI:10.1111/j.1476-5381.2012.01847.x.
- Suzuki S, Yokoyama U*, Abe T, Kiyonari H, Yamashita N, Kato Y, Kurotani R, Sato M, Okumura S, and Ishikawa Y. Differential roles of Epac in regulating cell death in neuronal and myocardial cells. J Biol Chem, 2010. 285: 24248-24259. DOI:10.1074/jbc.M109.094581.
- Yokoyama U, Patel HH, Lai NC, Aroonsakool N, Roth DM, and Insel PA. The cyclic AMP effector Epac integrates pro- and anti-fibrotic signals. Proc Natl Acad Sci U S A, 2008. 105: 6386-6391. DOI:10.1073/pnas.0801490105.
- Yokoyama U, Minamisawa S, Quan H, Akaike T, Jin M, Otsu K, Ulucan C, Wang X, Baljinnyam E, Takaoka M, Sata M, and Ishikawa Y. Epac1 is upregulated during neointima formation and promotes vascular smooth muscle cell migration. Am J Physiol Heart Circ Physiol, 2008. 295: H1547-1555. DOI:10.1152/ajpheart.01317.2007.
